Полость рта – это не просто анатомическое начало пищеварительного тракта, но и сложная экосистема микроорганизмов, оказывающих влияние на общее состояние здоровья. Исследования подтверждают: воспаление дёсен повышает уровень цитокинов в крови, что способствует развитию атеросклероза, обострению диабета и снижает общий иммунитет у пациентов. Регулярные визиты к стоматологу и качественная чистка!.
Влияние полости рта на общее состояние организма
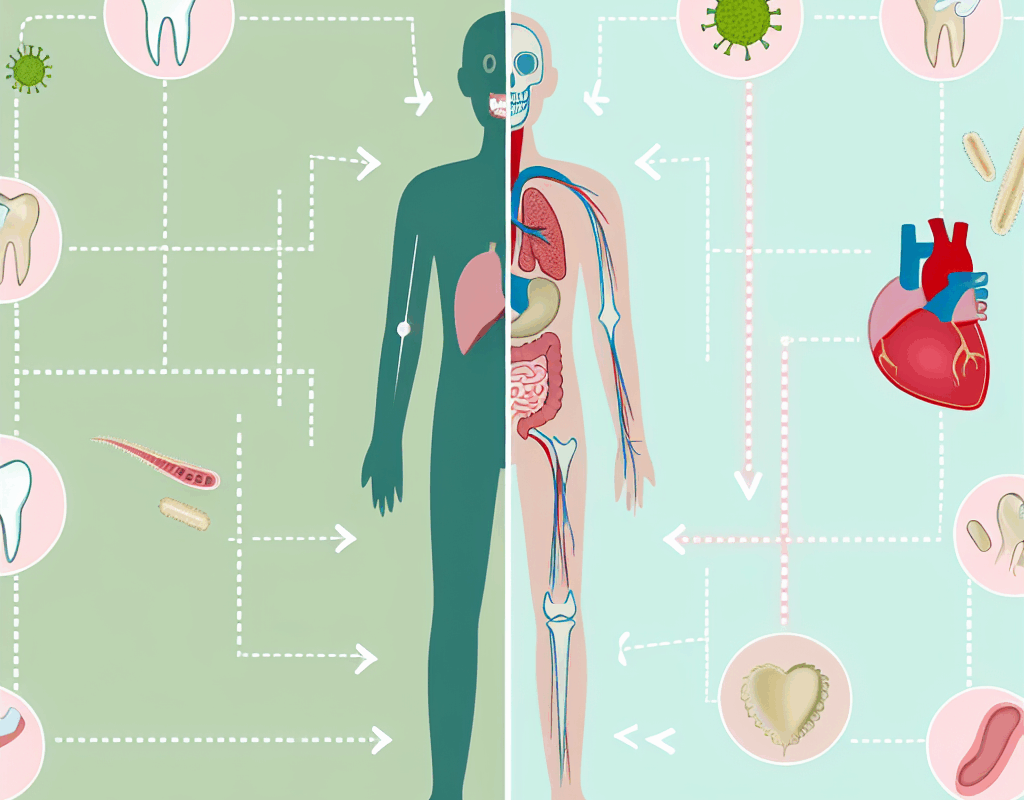
Полость рта является одним из главных барьеров и резервуаров для множества микроорганизмов, населяющих организм человека. В норме здесь обитают сотни видов бактерий, грибков и вирусов, которые образуют уникальный микробиом – совокупность микроорганизмов, обитающих в конкретной биологической среде. Он выполняет сразу несколько функций: участвует в процессах пищеварения и синтезе витаминов, защищает слизистую от патогенов и участвует в регуляции местных иммунных реакций. При этом с нарушением баланса микрофлоры полости рта связаны не только локальные стоматологические проблемы, но и многочисленные системные эффекты. Дисбиоз орального микробиома может провоцировать рост патогенных форм, усиливать воспалительные процессы и снижать барьерную функцию слизистой оболочки, что в свою очередь позволяет микробным эндотоксинам проникать в системный кровоток.
За счет постоянного обмена слюной и микроциркуляции бактерии и их продукты жизнедеятельности могут мигрировать на другие участки тела. Часто именно через капилляры и лимфатические сосуды они попадают в центральную нервную систему, дыхательную систему и даже в мелкие капилляры внутренних органов. В этом контексте болезни полости рта, такие как гингивит, пародонтит или кариес, выступают не только как эпизодические неприятности, требующие стоматологического вмешательства, но и как хронические очаги инфекции, оказывающие токсическое и воспалительное воздействие на весь организм. Микротравмы слизистой, возникающие при неправильном прикусе или некачественной гигиене, создают открытые ворота для проникновения микроорганизмов и продуктов их жизнедеятельности в кровь, что постепенно накапливает негативный эффект и усиливает хроническое воспаление.
На сегодняшний день накоплено большое количество клинических и эпидемиологических данных, подтверждающих взаимосвязь между состоянием полости рта и риском развития множества заболеваний. Помимо сердечно-сосудистой патологии и диабета, специалисты отмечают связь с дыхательной системой (особенно с хроническим обструктивным заболеванием легких), с заболеваниями печени и почек, а также с осложнениями при беременности. Так, у беременных женщин с выраженным пародонтитом повышается риск преждевременных родов и слабого веса ребенка при рождении. В своей совокупности эти эффекты демонстрируют, что оральная экология является важнейшим фактором, влияющим на иммунный статус, метаболические процессы и общее качество жизни человека.
Оральный микробиом и его ключевые компоненты
Оральный микробиом представляет собой динамическую экосистему, основной «населенной» средой которой являются зубы, десневые карманы, поверхность языка и слизистая оболочка щек. Несмотря на небольшие масштабы, микроокружение ротовой полости уникально по разнообразию и активности микробов. Большинство из них являются комменсалами – организмами, сосуществующими с хозяином без вреда для него. Однако при изменении условий среды они могут трансформироваться в оппортунистические патогены. Ключевыми группами микроорганизмов являются:
- Грамположительные кокки (Streptococcus, Actinomyces), участвующие в образовании зубного налёта;
- Грамотрицательные палочки (Prevotella, Fusobacterium), ассоциирующиеся с воспалительными процессами в десне;
- Анаэробные бактерии (Porphyromonas gingivalis), вырабатывающие эндотоксины и активирующие системные провоспалительные каскады;
- Грибы рода Candida, которые при дисбиозе могут приводить к кандидозному стоматиту;
- Вирусы (Herpes simplex, Epstein–Barr), способные вызывать рецидивирующие поражения слизистой.
Нормальная функция микробиома обеспечивается его устойчивостью к внешним воздействиям и наличием множества механизмов саморегуляции. Важную роль здесь играют слизистые антитела IgA, биологически активные пептиды и конкуренция между полезными и патогенными формами. При нарушении этого баланса выделяются факторы, способствующие усиленному росту патогенных бактерий, что провоцирует локальное воспаление и образование десневых карманов. В свою очередь, через эти карманы продукты жизнедеятельности бактерий и их токсичные метаболиты попадают в межклеточную жидкость и кровеносные сосуды, увеличивая общий воспалительный фон и риски для здоровья всего организма.
Комплексное понимание структуры и функций орального микробиома позволяет разрабатывать более эффективные профилактические и лечебные подходы. Это включает не только традиционные методы профессиональной гигиены и медикаментозного воздействия, но и использование пребиотиков, пробиотиков и синбиотиков, направленных на восстановление микробиологического равновесия. Ключевым элементом остаётся персонализированный подход, учитывающий генетическую предрасположенность, особенности питания и образ жизни пациента.
Связь полости рта с сердечно-сосудистыми заболеваниями
Хроническое воспаление дёсен и другие проблемы в полости рта давно рассматриваются в качестве факторов риска для сердечно-сосудистой системы. Серьёзный вклад в понимание этой связи внесли многочисленные клинические исследования и мета-анализы, в которых принимали участие тысячи пациентов. Основные механизмы, связывающие заболевания пародонта с поражением сосудов, включают прямой перенос бактерий и их эндотоксинов в системный кровоток, повышение уровня провоспалительных цитокинов и острофазовых белков (таких как С-реактивный белок и интерлейкин-6), а также иммунное перекрёстное реагирование, при котором антитела, направленные против патогенов полости рта, ошибочно атакуют эндотелиоциты сосудов.
По данным крупных регистровых исследований, у пациентов с хроническим пародонтитом риск развития инфаркта миокарда увеличивается в среднем на 20–30%, а риск инсульта — на 30–50% по сравнению с популяцией без воспаления дёсен. В биологических образцах атеросклеротических бляшек у таких пациентов обнаруживаются прямые антигены бактерий Porphyromonas gingivalis, что подтверждает их вклад в атерогенез. Кроме того, системная воспалительная реакция способствует повышению уровня фибриногена и усиленному тромбообразованию, усугубляя вероятность острых коронарных событий и нарушений мозгового кровообращения.
Более того, хроническое воспаление дёсен запускает каскад иммунных реакций с вовлечением макрофагов, нейтрофилов и цитотоксических Т-лимфоцитов, которые активно мигрируют к очагу инфекции и продуцируют высокие концентрации свободных радикалов и провоспалительных медиаторов. Это приводит к окислению липидов в сосудистой стенке, образованию пенистых клеток и формированию атерогенных бляшек. Длительное присутствие патогенного воспалительного фона создаёт условия для прогрессии стеноза артерий и увеличивает вероятность разрыва бляшек с последующим тромбообразованием.
Механизмы атерогенеза при воспалении дёсен
В основе атеросклеротического процесса лежит сложное взаимодействие локальных и системных факторов. При пародонтите ключевую роль играют:
- Трансцитоз и пассивная диффузия бактериальных эндотоксинов (липополисахаридов) через повреждённый эндотелий сосудов;
- Стимуляция синтеза С-реактивного белка (CRP) в печени и системное повышение его концентрации в плазме;
- Выделение интерлейкина-6, усиливающего проницаемость сосудистой стенки и привлекающего моноциты к очагу воспаления;
- Фагоцитоз липидов макрофагами с образованием пенистых клеток и последующим накапливанием жировых капель в интиме;
- Активация тромбоцитов и повышение уровня фибриногена, что способствует склонности к тромбообразованию в местах атеросклеротических бляшек.
В совокупности описанные процессы приводят к формированию стабильных и нестабильных атеросклеротических бляшек, которые могут осложняться разрывом и острым нарушением кровотока. Клинические исследования показывают, что при каждом обострении пародонтита уровень маркеров системного воспаления увеличивается, а функции эндотелия ухудшаются. Своевременная диагностика и лечение воспалительных заболеваний полости рта позволяют существенно снизить эти риски.
Комплексная терапия хронического пародонтита включает не только механическую очистку зубов и десневых карманов, но и фото- и лазерную терапию, антисептические полоскания, системное и местное применение антибактериальных препаратов, а также коррекцию факторов риска (курение, гипергликемия, дислипидемия). Такой мультидисциплинарный подход требует взаимодействия стоматолога, кардиолога и эндокринолога для выработки оптимальной схемы лечения и профилактики осложнений со стороны сердечно-сосудистой системы.
FAQ
- В чём опасность хронического пародонтита? – Он повышает уровень системного воспаления, способствует образованию атеросклеротических бляшек и ухудшает контроль гликемии у пациентов с диабетом.
- Можно ли снизить риск сердечно-сосудистых осложнений, ухаживая за дёснами? – Да, регулярная профессиональная чистка и хорошая гигиена полости рта уменьшают воспалительный фон и снижают концентрацию провоспалительных маркеров.
- Как часто нужно посещать стоматолога при пародонтите? – Обычно рекомендовано посещать специалиста каждые 3–4 месяца для оценки глубины десневых карманов и проведения профессиональной чистки.
- Какие маркеры воспаления важны при пародонтите? – CRP, IL-6 и фибриноген отражают системную активность воспаления и коррелируют с риском сердечно-сосудистых заболеваний.
- Можно ли бороться с пародонтитом дома? – Домашний уход важен, но без профессиональной чистки и квалифицированной диагностики полностью устранить проблему нельзя.
- Помогают ли пробиотики при проблемах с дёснами? – Некоторые штаммы могут нормализовать микрофлору и снизить уровень патогенных бактерий, однако эффект зависит от сочетания с другими методами лечения.
- Нужно ли ограничивать сахар при заболеваниях дёсен? – Да, избыток простых углеводов питает патогенные микроорганизмы и усиливает воспалительные процессы в пародонте.
- Есть ли генетический тест для оценки рисков пародонтита? – Современные исследования позволяют выявить полиморфизмы генов воспаления, но пока эти тесты не получили широкого клинического применения.